
El átomo es una estructura en la cual se organiza la materia en el mundo físico o en la naturaleza. Su estructura está compuesta por diferentes combinaciones de tres sub-partículas: los neutrones, los protones y los electrones.
Definición de átomo: “Es la partícula más pequeña de la que puede estar constituido un elemento y mediante su combinación se forman las moléculas”.
Esta definición proviene del griego, que significa indivisible. En el momento que se bautizaron estas partículas se creía que efectivamente no se podían dividir.
Estructura atómica, las partes de un átomo
El átomo, de acuerdo con el modelo atómico actual, está dividido en dos partes:
-
El núcleo: esta parte está formada por neutrones y protones.
-
La corteza: formada únicamente por electrones.
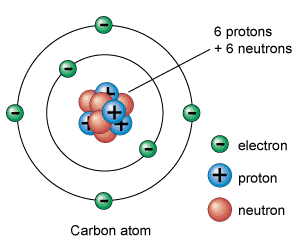
Partículas subatómicas: protones, neutrones y electrones
Los protones, neutrones y electrones son las partículas subatómicas que forman los átomos. La forma como se organizan entre ellas es lo que define cada elemento químico.
Los electrones son las partículas subatómicas más ligeras y tienen una carga eléctrica negativa. Los protones tienen carga positiva y pesan unas 1.836 veces más que los electrones. Finalmente, los neutrones no tienen carga eléctrica y pesan aproximadamente lo mismo que los protones.
Los protones y neutrones se encuentran agrupados en el núcleo atómico (por eso también se llaman nucleones) gracias a unas fuerzas nucleares que les mantienen unidos. Por lo tanto, el núcleo atómico, tiene una carga positiva (la de los protones) en la que se concentra casi toda su masa.
Por otra parte, alrededor del núcleo hay un cierto número de electrones, cargados negativamente. La carga total del núcleo (positiva) es igual a la carga negativa de los electrones, de modo que la carga eléctrica total es neutra.
Descubrimiento del modelo atómico actual
Antes de llegar a los conocimientos actuales sobre la estructura del átomo, a lo largo de la historia se han ido desarrollando diferentes teorías atómicas sobre la composición de la materia.
A partir de las teorías atómicas, los científicos han ido presentando unos modelos atómicos que poco a poco han ido evolucionando.
El primer modelo que presentó John Dalton ha ido evolucionando hasta llegar al modelo atómico de Niels Bohr. Bohr presentaba un modelo muy parecido al actual con los electrones girando alrededor del núcleo.
Características de los átomos
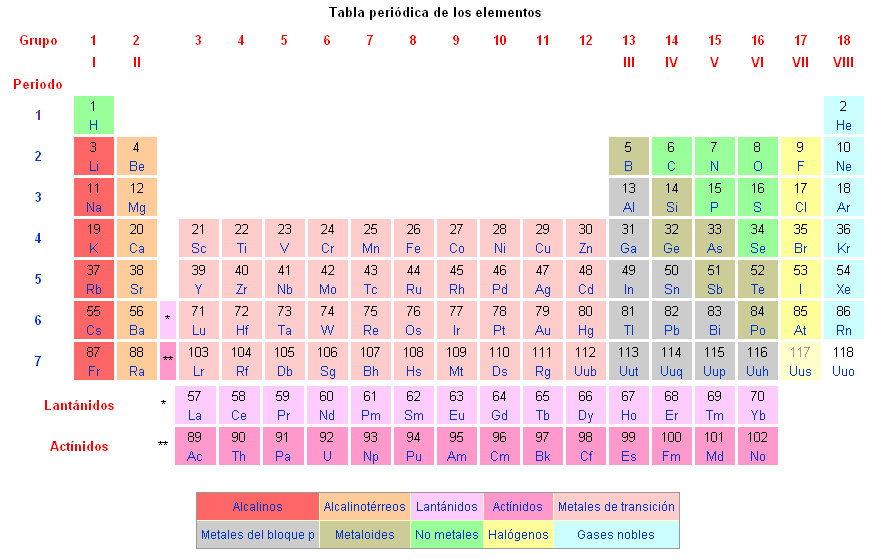
Según la composición de los átomos se diferencian los distintos elementos químicos representados en la tabla periódica de los elementos químicos.
 Las propiedades que definen los átomos son:
Las propiedades que definen los átomos son:
-
El número atómico (Z) que indica la cantidad de protones en el núcleo. Todos los átomos con un mismo número de protones pertenecen al mismo elemento. Por ejemplo, los que tienen un solo protón son átomos de hidrógeno.
-
El número másico hace referencia a la suma de protones y neutrones. Los elementos con diferente número de neutrones pertenecen a isótopos distintos del mismo elemento.
-
La electronegatividad es la tendencia que un átomo tiene para atraer electrones al formar un enlace químico.
-
El radio atómico corresponde a la mitad de la distancia entre dos núcleos de un mismo elemento enlazados entre sí.
-
El potencial de ionización es la energía necesaria para separar un electrón del elemento.
Relación de los átomos con las moléculas
Una molécula se forma cuando dos o más átomos se unen mediante enlaces químicos. Los átomos pueden unirse entre sí mediante enlaces. Estos enlaces se forman cuando los átomos comparten, ganan o pierden electrones para lograr una configuración electrónica más estable.
En una molécula, los átomos están dispuestos en una estructura tridimensional y se mantienen unidos por los enlaces químicos. La forma en que se unen los átomos en una molécula determina sus propiedades químicas y físicas, así como su comportamiento en las reacciones químicas.
¿De donde proviene la energía de los átomos?
La energía de los átomos proviene principalmente de dos fuentes:
- la energía nuclear
- la energía electrónica.
Energía nuclear
La energía nuclear está relacionada con las fuerzas que mantienen unidos los núcleos atómicos. La energía nuclear se libera o se absorbe durante los procesos nucleares, como la fisión nuclear y la fusión nuclear. En la fisión nuclear, se divide un núcleo pesado en núcleos más pequeños, y en la fusión nuclear, se unen dos núcleos ligeros para formar uno más pesado. Ambios procesos liberan energía debido a las diferencias en las masas de los núcleos involucrados, según la famosa ecuación de Einstein, E = mc².
Energía electrónica
Por su parte, la energía electrónica está asociada con la configuración de los electrones en los átomos. Los electrones orbitan alrededor del núcleo atómico en niveles de energía o capas electrónicas.
Los electrones pueden moverse entre estos niveles de energía mediante la absorción o emisión de energía en forma de fotones. Cuando los electrones absorben energía, pueden saltar a niveles de energía más altos. Cuando liberan energía, vuelven a niveles de energía más bajos.
Estos cambios de energía electrónica son responsables de la emisión y absorción de luz, así como de otras formas de radiación electromagnética, como los rayos X.
