
Los elementos químicos son las unidades básicas de la materia. Están formados por átomos que contienen un número específico de protones en su núcleo, conocido como número atómico. Este número es único para cada elemento y define sus propiedades químicas y físicas.
Los elementos se agrupan en la tabla periódica, que organiza estos elementos según sus características y comportamientos. Además, pueden combinarse entre sí a través de reacciones químicas para formar compuestos con nuevas propiedades, como ocurre cuando el oxígeno y el hidrógeno se combinan para formar agua.
Definición de elemento en química
 Un elemento químico es una sustancia pura compuesta por átomos que tienen el mismo número de protones en su núcleo, conocido como número atómico. Este número distingue a cada elemento y es la característica que lo define.
Un elemento químico es una sustancia pura compuesta por átomos que tienen el mismo número de protones en su núcleo, conocido como número atómico. Este número distingue a cada elemento y es la característica que lo define.
El término "especie química" también se utiliza para referirse a un átomo, aunque también puede hacer referencia a moléculas, iones y otras sustancias.
Cada elemento tiene un símbolo químico, compuesto por una o dos letras, y un nombre que generalmente proviene del latín. Estos símbolos y nombres están regulados por la IUPAC y se encuentran reflejados en la tabla periódica de Mendeleev.
Elementos y sustancias simples
Cuando los elementos químicos existen de manera aislada, se les conoce como sustancias simples.
Es importante distinguir entre los elementos químicos, que son entidades abstractas descritas por sus características, y los objetos materiales, que son las sustancias que realmente existen en la naturaleza. Estas últimas pueden ser compuestos químicos simples con propiedades físicas y químicas bien definidas.
Gases nobles
Dentro de los elementos químicos, un grupo particular son los gases nobles.
Estos elementos comparten propiedades muy similares: son gases monoatómicos, incoloros, inodoros y tienen una reactividad química extremadamente baja. Ejemplos de gases nobles incluyen el helio, el neón y el argón.
Combinación de elementos
 Los elementos químicos pueden reaccionar entre sí para formar nuevos compuestos, un proceso que se da en las reacciones químicas.
Los elementos químicos pueden reaccionar entre sí para formar nuevos compuestos, un proceso que se da en las reacciones químicas.
Por ejemplo, el oxígeno y el hidrógeno, dos elementos gaseosos, pueden combinarse para formar agua, un compuesto con propiedades completamente diferentes a las de sus elementos constituyentes.
¿Cuántos son los elementos químicos?
Se conocen 118 elementos químicos, de los cuales 94 se encuentran en la naturaleza (algunos solo en pequeñas cantidades). Los 24 restantes se obtienen artificialmente como resultado de reacciones nucleares. Estos elementos son fundamentales en la investigación científica y en diversas aplicaciones tecnológicas.
Isótopos
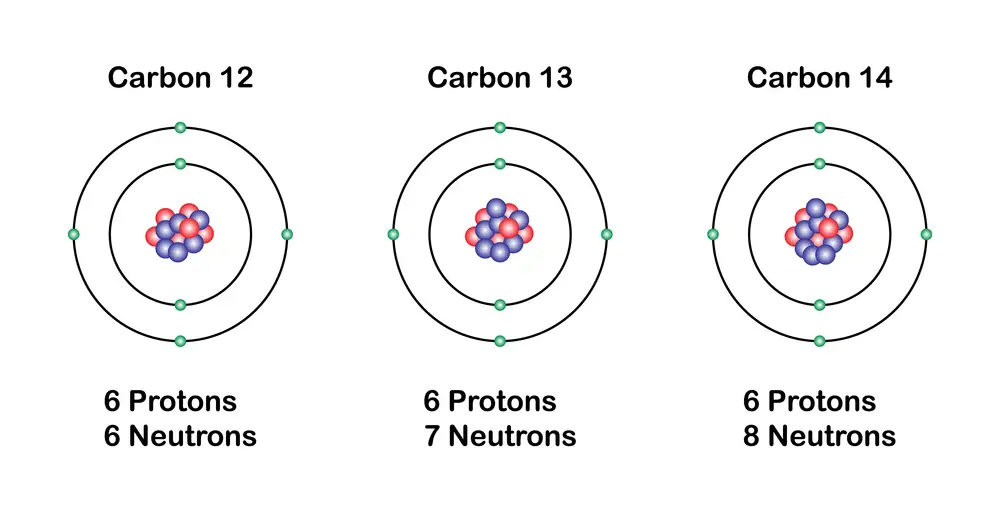 Un aspecto importante de los elementos es la existencia de isótopos, que son variantes de un mismo elemento químico.
Un aspecto importante de los elementos es la existencia de isótopos, que son variantes de un mismo elemento químico.
Los isótopos tienen el mismo número de protones pero un número diferente de neutrones. Esto provoca que tengan masas atómicas distintas. Aunque los isótopos de un elemento tienen propiedades químicas similares, sus propiedades físicas (como la estabilidad y la radiactividad) pueden variar considerablemente.
Por ejemplo, el carbono tiene dos isótopos estables, el carbono-12 y el carbono-13, y un isótopo radiactivo, el carbono-14, que es utilizado en datación arqueológica.
Isótopos en la indústria nuclear
Algunos isótopos son fundamentales en aplicaciones nucleares, especialmente en reactores nucleares. A continuación te muestro los más importantes:
- Uranio-235 (U-235): Es uno de los isótopos más importantes en los reactores nucleares. Su capacidad para fisionarse al ser bombardeado con neutrones lo convierte en un combustible crucial para la generación de energía nuclear. El Uranio-235 se encuentra en concentraciones muy pequeñas en la naturaleza, por lo que debe ser enriquecido para ser utilizado en reactores.
- Plutonio-239 (Pu-239): Este isótopo se produce en los reactores nucleares a partir de Uranio-238. Cuando el Uranio-238 absorbe un neutrón, se convierte en Plutonio-239, el cual también es fisionable y puede ser utilizado como combustible en los reactores nucleares.
- Deuterio (H-2): Un isótopo del hidrógeno que se encuentra en el agua y es utilizado en los reactores de fisión nuclear. El Deuterio, junto con el tritio (H-3), se utiliza en los reactores de fusión experimental, donde los isótopos de hidrógeno se fusionan para liberar energía.
- Tritio (H-3): Aunque es radiactivo y tiene una vida media corta, el Tritio es un isótopo utilizado en ciertos tipos de reactores nucleares de fusión. Este isótopo se produce artificialmente y se usa en experimentos de fusión nuclear, como los realizados en los reactores de fusión ITER.
Clasificación de los elementos
Los elementos químicos se clasifican en metales, no metales y metaloides, dependiendo de sus propiedades.
Los metales, que constituyen la mayoría de los elementos, son buenos conductores de electricidad y calor, mientras que los no metales tienden a ser aislantes. Los metaloides, por su parte, tienen propiedades intermedias entre los metales y no metales.
En la tabla periódica, los elementos se disponen en filas llamadas periodos y en columnas denominadas grupos. Los elementos de un mismo grupo comparten propiedades químicas similares.
¿De qué depende el nombre de los elementos?
El derecho a proponer un nombre para un nuevo elemento químico lo tienen los descubridores del mismo.
Sin embargo, este nombre debe cumplir ciertas reglas. Después de la publicación de un nuevo descubrimiento, su existencia debe ser verificada por laboratorios independientes. Si se confirma, la IUPAC aprueba oficialmente el nombre del nuevo elemento.
Actualmente, los 118 elementos conocidos tienen nombres permanentes aprobados por la IUPAC, y antes de que se apruebe el nombre definitivo, se utilizan nombres temporales basados en su número atómico.
Classificación de los elementos en la tabla periódica
Los elementos químicos se encuentran clasificados en la tabla periódica de los elementos.
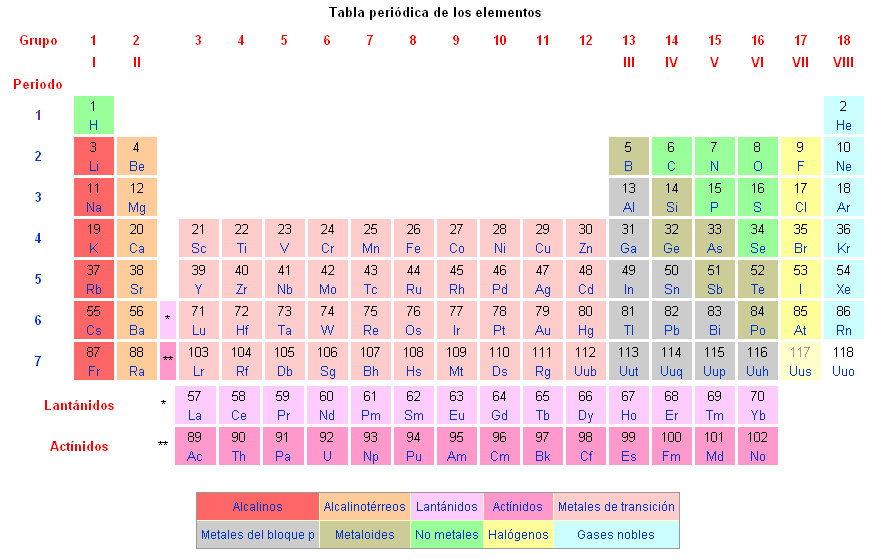
Los elementos químicos conocidos son los siguientes:
|
Elemento químico |
Símbolo |
Número atómico (Z) |
Peso atómico (u) |
|
Hidrógeno |
H |
1 |
1.0079 |
|
Helio |
He |
2 |
4.0026 |
|
Litio |
Li |
3 |
6941 |
|
Berilio |
Be |
4 |
9.0122 |
|
Boro |
B |
5 |
10811 |
|
Carbono |
C |
6 |
12.0107 |
|
Nitrógeno |
N |
7 |
14.0067 |
|
Oxígeno |
O |
8 |
15.9994 |
|
Flúor |
F |
9 |
18.9984 |
|
Neón |
Ne |
10 |
20.1797 |
|
Sodio |
Na |
11 |
22.9897 |
|
Magnesio |
Mg |
12 |
24305 |
|
Aluminio |
Al |
13 |
26.9815 |
|
Silicio |
Si |
14 |
28.0855 |
|
Fósforo |
P |
15 |
30.9738 |
|
Azufre |
S |
16 |
32065 |
|
Cloro |
Cl |
17 |
35453 |
|
Argón |
Ar |
18 |
39948 |
|
Potasio |
K |
19 |
39.0983 |
|
Calcio |
Ca |
20 |
40078 |
|
Escandio |
Sc |
21 |
44.9559 |
|
Titanio |
Ti |
22 |
47867 |
|
Vanadio |
V |
23 |
50.9415 |
|
Cromo |
Cr |
24 |
51.9961 |
|
Manganeso |
Mn |
25 |
54938 |
|
Hierro |
Fe |
26 |
55845 |
|
Cobalto |
Co |
27 |
58.9332 |
|
Níquel |
Ni |
28 |
58.6934 |
|
Cobre |
Cu |
29 |
63546 |
|
Zinc |
Zn |
30 |
65.39 |
|
Galio |
Ga |
31 |
69723 |
|
Germanio |
Ge |
32 |
72.64 |
|
Arsénico |
As |
33 |
74.9216 |
|
Selenio |
Se |
34 |
78.96 |
|
Bromo |
Br |
35 |
79904 |
|
Kriptón |
Kr |
36 |
83.8 |
|
Rubidio |
Rb |
37 |
85.4678 |
|
Estroncio |
Sr |
38 |
87.62 |
|
Itrio |
Y |
39 |
88.9059 |
|
Zirconio |
Zr |
40 |
91224 |
|
Niobio |
Nb |
41 |
92.9064 |
|
Molibdeno |
Mo |
42 |
95.94 |
|
Tecnecio |
Tc |
43 |
98 |
|
Rutenio |
Ru |
44 |
101.07 |
|
Rodio |
Rh |
45 |
102.9055 |
|
Paladio |
Pd |
46 |
106.42 |
|
Plata |
Ag |
47 |
107.8682 |
|
Cadmio |
Cd |
48 |
112411 |
|
Indio |
In |
49 |
114818 |
|
Estaño |
Sn |
50 |
118.71 |
|
Antimonio |
Sb |
51 |
121.76 |
|
Teluro |
Te |
52 |
127.6 |
|
Yodo |
I |
53 |
126.9045 |
|
Xenón |
Xe |
54 |
131293 |
|
Cesio |
Cs |
55 |
132.9055 |
|
Bario |
Ba |
56 |
137327 |
|
Lantano |
La |
57 |
138.9055 |
|
Cerio |
Ce |
58 |
140116 |
|
Praseodimio |
Pr |
59 |
140.9077 |
|
Neodimio |
Nd |
60 |
144.24 |
|
Prometio |
Pm |
61 |
145 |
|
Samario |
Sm |
62 |
150.36 |
|
Europio |
Eu |
63 |
151964 |
|
Gadolinio |
Gd |
64 |
157.25 |
|
Terbio |
Tb |
65 |
158.9253 |
|
Disprosio |
Dy |
66 |
162.5 |
|
Holmio |
Ho |
67 |
164.9303 |
|
Erbio |
Er |
68 |
167259 |
|
Tulio |
Tm |
69 |
168.9342 |
|
Iterbio |
Yb |
70 |
173.04 |
|
Lutecio |
Lu |
71 |
174967 |
|
Hafnio |
Hf |
72 |
178.49 |
|
Tantalio |
Ta |
73 |
180.9479 |
|
Wolframio |
W |
74 |
183.84 |
|
Renio |
Re |
75 |
186207 |
|
Osmio |
Os |
76 |
190.23 |
|
Iridio |
Ir |
77 |
192217 |
|
Platino |
Pt |
78 |
195078 |
|
Oro |
Au |
79 |
196.9665 |
|
Mercurio |
Hg |
80 |
200.59 |
|
Talio |
Tl |
81 |
204.3833 |
|
Plomo |
Pb |
82 |
207.2 |
|
Bismuto |
Bi |
83 |
208.9804 |
|
Polonio |
Po |
84 |
209 |
|
Astato |
At |
85 |
210 |
|
Radón |
Rn |
86 |
222 |
|
Francio |
Fr |
87 |
223 |
|
Radio |
Ra |
88 |
226 |
|
Actinio |
Ac |
89 |
227 |
|
Torio |
Th |
90 |
232.0381 |
|
Protactinio |
Pa |
91 |
231.0359 |
|
Uranio |
U |
92 |
238.0289 |
|
Neptunio |
Np |
93 |
237 |
|
Plutonio |
Pu |
94 |
244 |
|
Americio |
Am |
95 |
243 |
|
Curio |
Cm |
96 |
247 |
|
Berkelio |
Bk |
97 |
247 |
|
Californio |
Cf |
98 |
251 |
|
Einstenio |
Es |
99 |
252 |
|
Fermio |
Fm |
100 |
257 |
|
Mendelevio |
Md |
101 |
258 |
|
Nobelio |
No |
102 |
259 |
|
Laurencio |
Lr |
103 |
262 |
|
Rutherfordio |
Rf |
104 |
261 |
|
Dubnio |
Db |
105 |
262 |
|
Seaborgio |
Sg |
106 |
266 |
|
Bohrio |
Bh |
107 |
264 |
|
Hassio |
Hs |
108 |
277 |
|
Meitnerio |
Mt |
109 |
268 |
|
Darmstadtio |
Ds |
110 |
281 |
|
Roentgenio |
Rg |
111 |
272 |
|
Copernicio |
Cn |
112 |
285 |
|
Nihonio |
Nh |
113 |
286 |
|
Flerovio |
Fl |
114 |
289 |
|
Moscovio |
Mc |
115 |
288 |
|
Livermorio |
Lv |
116 |
292 |
|
Teneso |
Ts |
117 |
294 |
|
Oganesón |
Og |
118 |
294 |
Representación de un elemento químico
Los símbolos de elementos químicos se usan como abreviaturas para el nombre de los elementos. Como símbolo, generalmente toman la letra inicial del nombre del elemento y, si es necesario, agregan la siguiente o una de las siguientes. Por lo general, estas son las letras iniciales de los nombres latinos de los elementos.
 Tal sistema de símbolos químicos fue propuesto en 1814 por el químico sueco J. Berzelius. Los elementos utilizados antes de la aprobación oficial de sus nombres y símbolos permanentes consisten en tres letras, lo que significa que los nombres latinos de los tres dígitos en la notación decimal de su número atómico. También se usa el sistema de notación para homólogos superiores descritos anteriormente (Eka-Rn, Eka-Pb, etc.).
Tal sistema de símbolos químicos fue propuesto en 1814 por el químico sueco J. Berzelius. Los elementos utilizados antes de la aprobación oficial de sus nombres y símbolos permanentes consisten en tres letras, lo que significa que los nombres latinos de los tres dígitos en la notación decimal de su número atómico. También se usa el sistema de notación para homólogos superiores descritos anteriormente (Eka-Rn, Eka-Pb, etc.).
Los números más pequeños al lado del símbolo del elemento indican:
-
La masa atómica en la parte superior izquierda.
-
Número atómico en la parte inferior izquierda.
