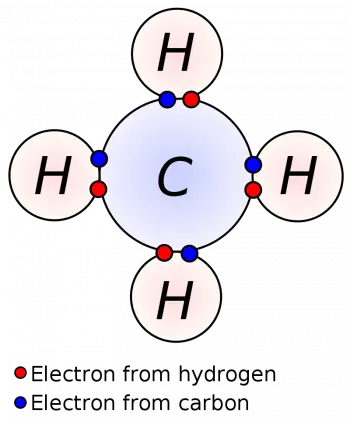
El modelo atómico de Lewis, también conocido como la estructura de Lewis, es un método utilizado para representar la distribución de electrones en un átomo o una molécula. Fue propuesto por el químico estadounidense Gilbert N. Lewis en 1916.
Según el modelo de Lewis, los átomos están formados por un núcleo central que contiene protones y neutrones, y los electrones se distribuyen en niveles de energía o capas electrónicas alrededor del núcleo. La capa más interna, más cercana al núcleo, puede contener hasta 2 electrones, mientras que las capas externas pueden contener más.
En la representación de Lewis, se utilizan puntos o símbolos para representar los electrones. Los electrones de valencia, que son los electrones en la capa más externa del átomo, se representan como puntos alrededor del símbolo del elemento químico. Se colocan un máximo de dos puntos en cada lado (arriba, abajo, izquierda y derecha) antes de emparejar los puntos adicionales.
Esta concepción de la estructura atómica fue un avance significativo, ya que proporcionaba una forma visual y simplificada de representar la estructura electrónica de los átomos y la formación de enlaces químicos.
Aunque ha sido complementado y extendido por teorías más avanzadas, sigue siendo una herramienta valiosa en la química para comprender la distribución de electrones y las interacciones entre átomos en las moléculas.
Contexto histórico de los modelos atómicos
Antes del modelo de Lewis, hubo otros modelos atómicos importantes, como el modelo de Thomson, el modelo de Rutherford y el modelo de Bohr.
Cada uno de estos modelos aportó nuevos conocimientos y perspectivas sobre la naturaleza de los átomos, pero también presentaba limitaciones que no podían explicar completamente ciertos fenómenos observados.
El modelo de Thomson, propuesto a finales del siglo XIX, describía el átomo como una esfera positiva con electrones incrustados en ella, similar a "pudín de pasas". Sin embargo, este modelo no podía explicar la estabilidad de los átomos ni la distribución de los electrones.
Posteriormente, el modelo de Rutherford, propuesto en 1911, sugirió que los átomos tenían un núcleo central denso y cargado positivamente, mientras que los electrones orbitaban alrededor de este núcleo. Aunque este modelo explicaba mejor la estabilidad de los átomos, aún no proporcionaba una descripción completa de cómo los electrones estaban distribuidos en sus órbitas.
Fue entonces cuando Gilbert N. Lewis propuso su modelo atómico en 1916, conocido como el modelo de Lewis. Este modelo se centró en la distribución de electrones de valencia, que son los electrones en la capa más externa de los átomos.
Lewis propuso que los electrones de valencia se distribuían en pares alrededor del átomo, y que los átomos interactuaban entre sí compartiendo o transfiriendo electrones para alcanzar una configuración estable.
¿Para qué sirve el modelo de Lewis?
El modelo de Lewis es una herramienta fundamental en química y tiene varios usos importantes:
-
Representación de la estructura electrónica: El modelo de Lewis permite visualizar de manera clara y concisa la distribución de electrones en átomos, moléculas e iones. Ayuda a comprender la configuración electrónica de los átomos y la ubicación de los electrones en las diferentes capas electrónicas.
-
Predicción de la formación de enlaces: El modelo permite predecir cómo los átomos se unen entre sí para formar enlaces químicos. Representa la compartición o transferencia de electrones entre átomos para lograr una configuración electrónica más estable.
-
Identificación de los electrones de valencia: Los electrones de valencia son los electrones en la capa más externa de un átomo y juegan un papel crucial en las reacciones químicas. La concepción de este modelo ayuda a identificar los electrones de valencia y entender cómo interactúan con otros átomos.
-
Representación de moléculas: El modelo de Lewis se utiliza para representar la estructura molecular de compuestos químicos. Ayuda a visualizar la disposición de los átomos y los enlaces químicos en una molécula.
-
Predicción de la geometría molecular: proporciona información sobre la distribución de electrones y puede utilizarse para predecir la geometría molecular. Esto es importante para comprender las propiedades físicas y químicas de las moléculas, así como su actividad biológica.
-
Interpretación de reacciones químicas: este modelo atómico facilita la interpretación de reacciones químicas al mostrar cómo los átomos y los electrones están involucrados en los cambios químicos.


