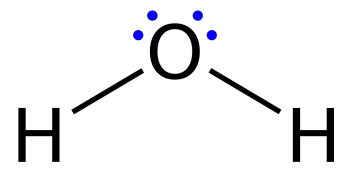
Las estructuras de Lewis, también llamada diagrama de punto o modelo de Lewis, son diagramas que muestran el enlace entre los átomos de una molécula junto con los pares de electrones existentes. Se puede dibujar una estructura de Lewis para cada molécula enlazada covalentemente, así como para compuestos de coordinación.
Las estructuras de Lewis reciben su nombre de Gilbert Newton Lewis, que las introdujo en 1916.
Son similares los diagramas utilizados para representar una configuración electrónica de puntos donde los electrones de valencia en pares solitarios están representados por puntos, pero también pueden contener líneas que representan pares compartidos en un enlace químico (simple, doble, triple, etc.).
Las líneas se dibujan entre átomos enlazados entre sí (se pueden utilizar también pares de puntos). Los electrones en exceso que forman pares solitarios están representados por pares de puntos colocados junto a los átomos.
¿Para qué sirve la estructura de Lewis?
Una estructura de Lewis es una representación gráfica que muestra la geometría molecular de un compuesto, los enlaces que se forman entre las moléculas y la distancia entre ellos. Es decir, estas estructuras muestran cada átomo y su posición en la estructura de la molécula utilizando su símbolo químico.
Los modelos de Lewis sirven para representar la cantidad de electrones de valencia de un elemento que interactúa con otros elementos químicos de la misma u otra especie formando enlaces.
¿Cómo se construye un diagrama de puntos de Lewis?
Para representar la estructura de Lewis de una molécula se necesita presentar un átomo central. Los demás elementos que constituyen la molécula se representan rodeando al átomo central.
El átomo central en lo posible debe ser el menos electronegativo, por ejemplo el carbono. Por otro lado, el hidrógeno siempre se representa como un átomo terminal.
La regla del octeto
La regla del octeto es una regla que establece que los átomos se enlazan entre ellos con el objetivo de completar su última capa de la configuración electrónica.
Esta regla determina que los átomos estables tienen ocho electrones en su capa de valencia.
Para poder conseguir esta estabilidad, cada átomo necesita compartir, perder o ganar electrones en los enlaces químicos que forma hasta tener los ocho electrones requeridos en la capa de valencia.
Al dibujar un diagrama evitaremos asignar más de ocho electrones a cada elemento por qué cada enlace covalente simple aporta dos electrones a cada átomo de la unión.
Electrones de valencia
El número total de electrones representados en el modelo de Lewis corresponde a la suma de los números de los electrones de valencia de cada átomo individual. Por contra, los electrones solitarios que no son de valencia no se representan.
La valencia que se representa en la estructura de Lewis es el número de electrones en el último nivel de energía de cada elemento químico al hacer su configuración electrónica.
Una vez se han determinado los electrones de valencia se deben ubicar en el diagrama. A continuación, cuando se han colocado todos los pares de electrones solitarios, puede ser que los átomos no cumplan con la regla del octeto.
Todos los átomos de un diagrama deben quedar enlazados. En una estructura de Lewis, consideramos que un par de electrones forman un enlace entre dos átomos. Del mismo modo que consideramos que dos átomos comparten el mismo par del enlace, el átomo que originalmente tenía el par solitario sigue teniendo un octeto.
