Un protón es una partícula subatómica con carga eléctrica positiva que se encuentra dentro del núcleo atómico de los átomos. El número de protones en el núcleo atómico es el que determina el número atómico de un elemento que se indica en la tabla periódica de los elementos.
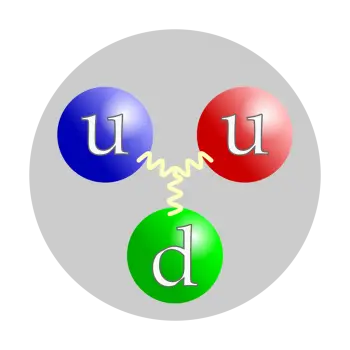
El protón no es una partícula elemental sino una partícula compuesta. Está formado por tres partículas unidas por gluones, dos quarks arriba y un quark abajo. Esta estructura significa que es un barión (un subtipo de las partículas llamadas hadrones).
Estas subpartículas atómicas están presentes en los núcleos atómicos, generalmente unidos a los neutrones por una fuerza nuclear fuerte. Al ser una de las partículas subatómicas que forman parte del núcleo es un nucleón. La única excepción en la que forma un núcleo atómico sin ningún neutrón es el núcleo del hidrógeno ordinario.
Pueden existir protones libres en plasmas (el cuarto estado de agregación de la materia), rayos cósmicos y el viento solar (corriente de partículas cargadas liberadas desde la atmósfera solar).
La vida de un protón es aproximadamente de 1035 años, por lo que se considera eterna a nivel experimental. Desde el punto de vista del modelo estándar de la física de partículas son partículas estables. Las leyes de la física no permiten que un nucleón se descomponga espontáneamente debido a la preservación del número de bariones.
¿Cuál es la masa de un protón?
Un protón tiene una masa de cerca de 1.674 x 10 -24g.
Este valor es aproximadamente la misma masa que los neutrones. En comparación con el electrón, la masa del protón es aproximadamente 1,836 veces mayor.
¿Cuál es la carga eléctrica de un protón?
El protón tiene una carga elemental positiva de 1,602 x 10 -19 coulombs. Exactamente la misma carga absoluta que el electrón pero de signo contrario.
¿Por qué son importantes los protones?
Los protones son importantes porque definen de qué elemento es un átomo.
El número atómico (Z) de un átomo es el número de protones en su núcleo y determina las propiedades químicas del átomo.
Para determinar los isótopos de un elemento, se utiliza también el número de neutrones (N) sumando todos los nucleones, y se conoce como número másico (A).
Otra característica importante es que su carga positiva contribuye a captar electrones y mantenerlos orbitando alrededor del núcleo del átomo.
¿Quién descubrió el protón?
El protón fué descubierto por Ernest Rutherford en el año 1919.

La historia de su descubrimiento se remonta a 1886, cuando Eugene Goldstein descubrió los rayos anódicos y demostró que eran partículas con carga positiva (iones) producidos a partir de los gases.
Con sus experimentos Goldstein observó que estas partículas tenían valores diferentes de relación entre carga y masa. Por este motivo no se pudo identificar la carga positiva con una partícula.
En 1911, Ernest Rutherford presentó su modelo atómico planetario. En este modelo ya establecía que en el centro del átomo se concentraba una carga eléctrica positiva rodeada de los electrones descubiertos por Thompson con carga negativa.
Rutherford liberó el núcleo del hidrógeno usando una fuente de radiactividad para producir partículas alfa energéticas. Con sus investigaciones, Rutherford demostró que el núcleo de hidrógeno estaba presente en otros núcleos.
El hidrógeno es el único elemento de la tabla periódica que tiene un único protón, por lo tanto, cuando se refería a un núcleo de hidrógeno era como hablar de un protón.
