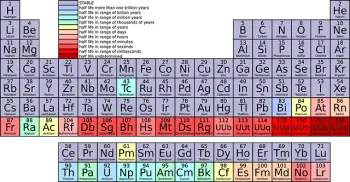
La tabla periódica de los elementos químicos es una de las herramientas más poderosas y esenciales en la química y la ciencia en general. Entre sus características más distintivas se encuentran las "familias" o "grupos" en las que los elementos químicos se organizan de acuerdo con sus propiedades similares.
Antes de sumergirnos en las familias específicas de la tabla periódica, es importante comprender su organización general:
¿Qué son las familias de la tabla periódica?
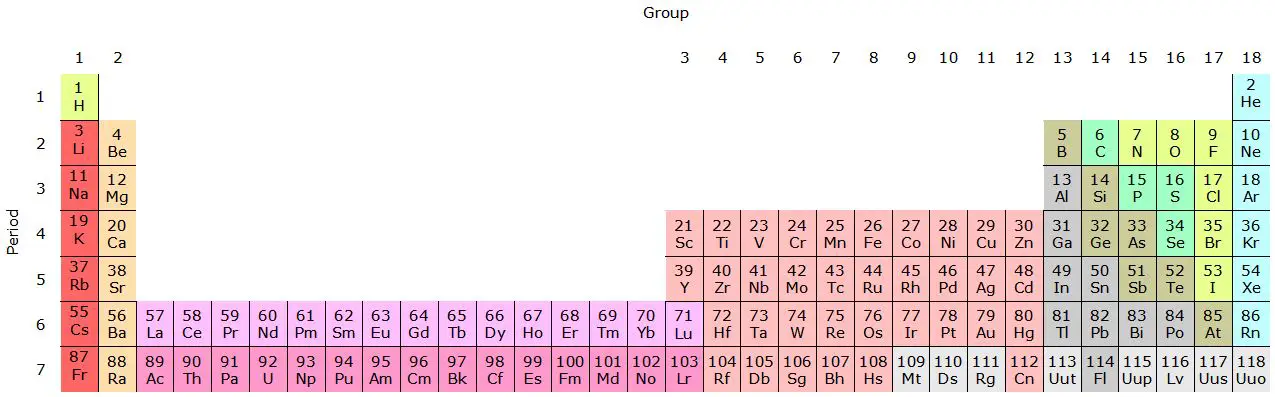 Las familias de la tabla periódica son grupos verticales de elementos con propiedades químicas similares debido a su configuración electrónica compartida en la capa más externa de electrones.
Las familias de la tabla periódica son grupos verticales de elementos con propiedades químicas similares debido a su configuración electrónica compartida en la capa más externa de electrones.
La tabla periódica se divide en filas horizontales llamadas "períodos" y columnas verticales llamadas "grupos" o "familias". Los elementos se organizan en orden creciente de número atómico, que es la cantidad de protones en el núcleo de un átomo.
Los elementos de cada familia comparten características y propiedades químicas similares. Cada familia tiene un número específico y se identifica con un número romano o un número ordinal (por ejemplo, el Grupo I o Grupo 1).
¿Por qué los elementos se organizan en familias?
En la década de 1860, Dmitri Mendeléyev estaba intentando ordenar los elementos conocidos en función de sus propiedades y masas atómicas.
Durante este proceso, notó que cuando los elementos se organizaban en filas en orden creciente de sus masas atómicas, se producían patrones repetitivos de propiedades químicas similares a cada cierta cantidad de elementos.
Esto lo llevó a la idea de que los elementos deberían organizarse en columnas o familias, donde los elementos en la misma columna tendrían propiedades químicas similares.
Las familias más importantes de la tabla periódica
Familia 1: Los metales alcalinos
 Los metales alcalinos son los elementos del grupo 1 de la tabla periódica, que incluye el hidrógeno (H), el litio (Li), el sodio (Na), el potasio (K), el rubidio (Rb), el cesio (Cs) y el francio (Fr).
Los metales alcalinos son los elementos del grupo 1 de la tabla periódica, que incluye el hidrógeno (H), el litio (Li), el sodio (Na), el potasio (K), el rubidio (Rb), el cesio (Cs) y el francio (Fr).
Propiedades básicas
Estos elementos son altamente reactivos y tienden a perder un electrón para formar iones positivos. Son conocidos por su capacidad para reaccionar vigorosamente con el agua y producir hidrógeno gaseoso.
Uso y aplicaciones
Los metales alcalinos encuentran aplicaciones en diversas áreas, desde baterías de iones de litio en dispositivos electrónicos hasta la fabricación de vidrio y la síntesis de compuestos químicos.
Familia 2: Los metales alcalinotérreos
La familia de los metales alcalinotérreos comprende los elementos del grupo 2 de la tabla periódica, que incluye el berilio (Be), el magnesio (Mg), el calcio (Ca), el estroncio (Sr), el bario (Ba) y el radio (Ra).
Propiedades básicas
Estos elementos también son metales, pero son menos reactivos que los metales alcalinos. Tienen dos electrones en su capa más externa y tienden a perder esos dos electrones en las reacciones químicas.
Uso y aplicaciones
Los metales alcalinotérreos son esenciales para la estructura de los huesos y dientes (calcio), la fabricación de aleaciones metálicas (magnesio) y la tecnología nuclear (radio).
Familia 17: Los halógenos
 Los halógenos forman la familia 17 de la tabla periódica e incluyen el flúor (F), el cloro (Cl), el bromo (Br), el yodo (I) y el ástato (At).
Los halógenos forman la familia 17 de la tabla periódica e incluyen el flúor (F), el cloro (Cl), el bromo (Br), el yodo (I) y el ástato (At).
Propiedades básicas
Estos elementos son altamente reactivos y tienden a ganar un electrón para formar iones negativos. Son conocidos por su capacidad para formar compuestos iónicos con los metales alcalinos y alcalinotérreos.
Uso y aplicaciones
Los halógenos encuentran aplicaciones en la desinfección del agua (cloro), la fabricación de productos farmacéuticos (yodo), y en la fotografía (bromuro de plata).
Familia 18: Los gases nobles
La familia de los gases nobles, también conocida como gases inertes, incluye el helio (He), el neón (Ne), el argón (Ar), el criptón (Kr), el xenón (Xe) y el radón (Rn).
Propiedades básicas
Estos elementos son conocidos por su baja reactividad química debido a que tienen una capa de electrones completamente llena.
Uso y aplicaciones
Esta estabilidad hace que los gases nobles sean útiles en aplicaciones como lámparas de neón, refrigeración criogénica y luces de señalización.
Familia de los lantánidos y actínidos
En la parte inferior de la tabla periódica, encontramos dos series de elementos conocidos como lantánidos y actínidos. Los lantánidos son elementos del bloque f, mientras que los actínidos son elementos del bloque f.
Los lantánidos y actínidos son dos series de elementos ubicadas en la parte inferior de la tabla periódica, y a menudo se los excluye de la numeración de grupos o familias típica de la tabla principal. Estas series se conocen como "series internas" o "series f". Estas series de elementos a menudo se llaman "tierras raras" debido a su relativa rareza en la corteza terrestre.
Aunque los lantánidos y actínidos no se numeran tradicionalmente como grupos en la tabla periódica, a veces se les asignan números romanos o se mencionan como "Grupo 3" para los lantánidos y "Grupo 4" para los actínidos como una forma simplificada de referirse a ellos.
Uso y aplicaciones
Los lantánidos son utilizados en la fabricación de imanes potentes, catalizadores químicos y en la industria de la electrónica. Por otro lado, los actínidos, incluyendo elementos como el uranio y el plutonio, son de gran importancia en la tecnología nuclear y la generación de energía.
Otras familias
Además de las familias mencionadas anteriormente, existen otros grupos de elementos en la tabla periódica con características y propiedades únicas.
Por ejemplo, el grupo 3 contiene los "lantánidos ligeros" y el grupo 16 contiene los "calcógenos", que incluyen oxígeno, azufre y selenio.
