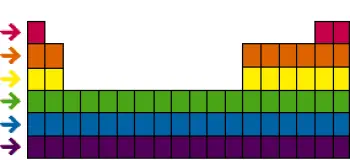
La tabla periódica de los elementos es una de las herramientas más poderosas y fundamentales en la química. Además de las familias o grupos, la tabla periódica también se organiza en "períodos" o "filas" horizontales.
Los períodos tienen una importancia significativa en la comprensión de la química de los elementos, ya que representan una disposición ordenada de los electrones en las capas electrónicas de los átomos.
La estructura de un período
Cada período de la tabla periódica representa una capa electrónica adicional en los átomos de los elementos a medida que avanzamos de izquierda a derecha en la tabla. Comenzando desde el primer período en la parte superior, que contiene solo dos elementos (hidrógeno y helio), los elementos en cada período tienen el mismo número de capas electrónicas.
Ejemplos
Por ejemplo, en el segundo período, los elementos como el litio, el berilio, el boro, el carbono, el nitrógeno, el oxígeno, el flúor y el neón, todos tienen dos capas electrónicas en sus átomos.
En el tercer período, los elementos como el sodio, el magnesio, el aluminio, el silicio, el fósforo, el azufre, el cloro y el argón tienen tres capas electrónicas, y así sucesivamente a medida que avanzamos a períodos más bajos.
Propiedades de los elementos en un período
Los elementos dentro de un mismo período tienen propiedades químicas y físicas que siguen ciertos patrones y tendencias:
Tamaño atómico

Esto se debe a que a medida que se agregan protones y electrones en la misma capa electrónica, la carga nuclear efectiva aumenta, lo que atrae más fuertemente a los electrones hacia el núcleo, reduciendo el tamaño del átomo.
Electronegatividad
La electronegatividad, que mide la tendencia de un átomo a atraer electrones compartidos en un enlace químico, tiende a aumentar a medida que avanzamos de izquierda a derecha en un período.
Los elementos en la parte derecha de un período son más electronegativos que los de la izquierda.
Reactividad
Los elementos en la misma columna de la tabla periódica (en el mismo grupo o familia) tienden a tener propiedades químicas similares debido a que tienen la misma cantidad de electrones en su capa de valencia.
Sin embargo, en un período, a medida que avanzamos de izquierda a derecha, los elementos tienden a volverse menos metálicos y más no metálicos en su comportamiento químico.
Por ejemplo, los metales alcalinos en el Grupo 1 son altamente reactivos, mientras que los elementos en la parte derecha de un período, como el flúor y el oxígeno, son no metales y tienden a formar compuestos covalentes.
Energía de Ionización
La energía de ionización, que es la energía requerida para eliminar un electrón de un átomo, generalmente aumenta a medida que avanzamos de izquierda a derecha en un período.
Los elementos en la parte derecha de un período tienen energías de ionización más altas, lo que significa que es más difícil eliminar un electrón de sus átomos.
Importancia de los períodos
 Los períodos en la tabla periódica son fundamentales para comprender cómo la estructura electrónica de los átomos influye en su comportamiento químico. Al observar las tendencias en las propiedades de los elementos a lo largo de un período, los químicos pueden predecir cómo los átomos interactuarán y formarán compuestos químicos.
Los períodos en la tabla periódica son fundamentales para comprender cómo la estructura electrónica de los átomos influye en su comportamiento químico. Al observar las tendencias en las propiedades de los elementos a lo largo de un período, los químicos pueden predecir cómo los átomos interactuarán y formarán compuestos químicos.
Además, la información sobre los períodos también es valiosa en la química inorgánica y en la síntesis de compuestos.
Por ejemplo, cuando se busca sintetizar un nuevo compuesto químico, conocer las propiedades de los elementos en el mismo período puede ayudar a los científicos a seleccionar los elementos apropiados para que reaccionen de la manera deseada.
Conclusion
Los períodos de la tabla periódica son una parte esencial de su organización y desempeñan un papel crucial en la comprensión de la química de los elementos.
A medida que avanzamos de izquierda a derecha en un período, podemos observar cómo las propiedades y el comportamiento de los elementos cambian de manera sistemática debido a la adición de capas electrónicas y la variación en la carga nuclear efectiva.
Esta organización ordenada de los elementos en períodos es un recordatorio de la profunda relación entre la estructura electrónica de los átomos y su química subyacente.
