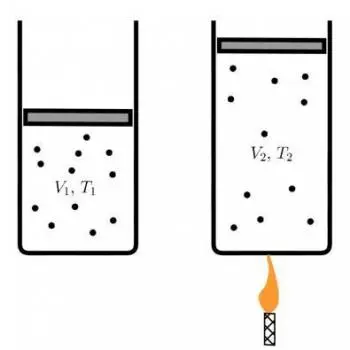
La ley de Charles, también conocida como ley de los volúmenes, es uno de los principios fundamentales en la termodinámica de los gases.
Esta ley, nombrada en honor al científico francés Jacques Charles, establece una relación crucial entre el volumen de un gas y su temperatura en grados Celsius (°C) a presión constante.
Formula de la ley de Charles
La formulación de la ley de Charles responde a la siguiente ecuación:
V1 / T1=V2 / T2
Donde:
- V1 es el volumen inicial del gas.
- T1 es la temperatura inicial en grados Celsius (°C).
- V2 es el volumen final del gas.
- T2 es la temperatura final en grados Celsius (°C).
Esta ecuación establece que la relación entre el volumen y la temperatura de un gas, a presión constante, es una relación directamente proporcional. Cuando la temperatura aumenta, el volumen también aumenta, y cuando la temperatura disminuye, el volumen del gas disminuye, siempre y cuando la presión se mantenga constante.
Historia y contexto de la ley
 La Ley de Charles es el resultado de los avances en la comprensión de los gases que tuvieron lugar en el siglo XVIII. Antes de la formulación de esta ley, científicos como Robert Boyle habían establecido la ley de Boyle-Mariotte, que describe la relación entre el volumen y la presión de un gas a temperatura constante.
La Ley de Charles es el resultado de los avances en la comprensión de los gases que tuvieron lugar en el siglo XVIII. Antes de la formulación de esta ley, científicos como Robert Boyle habían establecido la ley de Boyle-Mariotte, que describe la relación entre el volumen y la presión de un gas a temperatura constante.
En la misma época, Joseph Black había observado que la temperatura estaba relacionada con el volumen de un gas, aunque no había formulado una ley específica para esta relación.
El trabajo de Jacques Charles, un científico francés, fue esencial en la consolidación de esta relación. En 1787, Charles realizó una serie de experimentos que lo llevaron a la formulación de su ley.
Su observación fundamental fue que, a presión constante, el volumen de un gas aumenta de manera proporcional a su temperatura en grados Celsius. Esto significa que, si la temperatura de un gas se duplica, su volumen también se duplica, siempre y cuando la presión se mantenga constante.
Importancia en la termodinámica de gases
La ley de Charles es fundamental en la termodinámica de gases y tiene varias implicaciones importantes de las cuales destacamos dos:
Ecuación de los gases ideales: La Ley de Charles es una de las ecuaciones que conforman la ecuación general de los gases ideales. Esta ecuación, PV=nRT, relaciona la presión (P), el volumen (V), la cantidad de sustancia (n) y la temperatura (T) de un gas ideal. La relación entre el volumen y la temperatura a presión constante es un componente clave de esta ecuación.
Comportamiento de los gases: La ley ayuda a comprender cómo los gases se comportan en respuesta a los cambios de temperatura. Esta comprensión es esencial en diversas aplicaciones, como la producción de energía, la química industrial y la ingeniería.
Ejemplos de aplicaciones prácticas
 La ley de Charles tiene una amplia gama de aplicaciones prácticas en la vida cotidiana y en diversas industrias.
La ley de Charles tiene una amplia gama de aplicaciones prácticas en la vida cotidiana y en diversas industrias.
Algunos ejemplos de estas aplicaciones incluyen:
Refrigeración y aire acondicionado: Los sistemas de refrigeración y aire acondicionado se basan en el principio de que al comprimir un gas, su temperatura aumenta, y al expandirlo, su temperatura disminuye. Esto permite la regulación de la temperatura en espacios cerrados.
Globos aerostáticos: Los globos aerostáticos se llenan con aire caliente. Cuando se calienta el aire en el globo, su volumen aumenta, lo que le permite elevarse de acuerdo con el principio de Arquímedes. Precisamente Jacques Charles batió un récord de vuelo en globo aerostático.
Procesos de fabricación: En la industria, se utilizan hornos y reactores como los que se utilizan en las centrales nucleares que involucran vapor de agua y otros gases. La comprensión de la relación entre el volumen y la temperatura es esencial en la producción de productos químicos, metales y otros materiales.
Seguridad en la industria: La ley de Charles también es importante en la seguridad industrial. Comprender cómo los cambios de temperatura afectan el volumen de los gases es fundamental para evitar situaciones peligrosas en plantas químicas y procesos industriales.
Conclusión
La ley de Charles, formulada por Jacques Charles en el siglo XVIII, desempeña un papel crucial en la termodinámica de gases. Esta ley establece una relación directamente proporcional entre el volumen y la temperatura de un gas a presión constante.
Su importancia se refleja en una amplia gama de aplicaciones prácticas, desde sistemas de refrigeración y calefacción hasta la producción industrial y la seguridad en la manipulación de gases.
La obra de Charles es un testimonio de la importancia de las leyes fundamentales en la comprensión y aplicación de principios científicos en la vida cotidiana y en diversas industrias.
