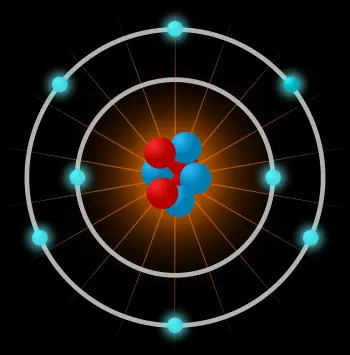
Un átomo es la unidad constituyente más pequeña de la materia ordinaria que tiene las propiedades de un elemento químico. El átomo está compuesto por:
-
El núcleo atómico: formado por unas partículas subatómicas llamadas nucleones. Los nucleones pueden ser neutrones o protones.
-
Una nube de electrones: otro tipo de partícula subatómica moviéndose alrededor del núcleo.
La principal diferencia entre protones, neutrones y electrones es su carga eléctrica. Los electrones tienen carga eléctrica negativa, los protones tienen carga positiva y los neutrones son partículas con carga eléctrica neutra.
Los átomos neutros tienen el mismo número de electrones que de protones ya que ambas subpartículas tienen la misma carga eléctrica.
Un átomo está constituido por un núcleo central muy denso, con los nucleones muy juntos, y por electrones que se mueven alrededor del núcleo a una distancia relativamente grande.
¿Cuál es la estructura del núcleo de un átomo?
El núcleo atómico es la parte central del átomo que está compuesto por nucleones unidos entre ellos por unos enlaces muy fuertes. Un nucleón puede ser un protón o un neutrón.
Debido a que los protones tienen una carga eléctrica positiva y los neutrones tienen carga neutra, la tendencia natural es la de separarse. Los enlaces que mantienen unidos los nucleones ejercen una fuerza nuclear mucho más intensa que la fuerza electromagnética a distancias cortas.
La fuerza de estos enlaces nucleares permite vencer la repulsión eléctrica entre los protones.
¿Qué es el número másico de un átomo?
El número másico de un átomo es el número de nucleones de su núcleo atómico, es decir, la suma de protones y neutrones.
El volumen del núcleo es aproximadamente proporcional al número total de nucleones, el número másico.
¿Qué representa el número atómico?
El número atómico es el número de protones que tiene un átomo y se representa por Z.
Los átomos se clasifican en la tabla periódica de los elementos según el número atómico.
Isótopos: átomos con una composición del núcleo diferente
Los átomos de un elemento químico deben tener la misma cantidad de protones, pero pueden tener un número distinto de neutrones. Se llaman isótopos los átomos de un mismo elemento con diferente número de neutrones.
Los isótopos se pueden encontrar en forma natural pero también se pueden manipular. Por ejemplo, el enriquecimiento de uranio consiste en incrementar el número de neutrones de un átomo de uranio para que sea más inestable y favorecer las reacciones de fisión.
¿Qué es la nube de electrones?
El electrón es una partícula elemental estable con la carga negativa más pequeña que existe en la naturaleza. Esta carga se denomina carga elemental, ya que cualquier carga eléctrica separable se compone de un número entero de ellas.
Los electrones tienen carga eléctrica negativa, por lo tanto son atraídos por los protones, de signo positivo en el átomo a través de la fuerza electromagnética. Esta fuerza aumenta al reducir la distancia entre el electrón y el núcleo.
La existencia del electrón la descubrió J.J. Thomson. A partir de este momento ya apareció en todos los modelos atómicos desarrollados en el futuro.
Orbitales atómicos: la probabilidad de encontrar un electrón en un punto
Los electrones tienden a formar un cierto tipo de onda estacionaria alrededor del núcleo atómico. Cada una de estas ondas está caracterizada por un orbital atómico, una función matemática que describe la probabilidad de encontrar al electrón en cada punto del espacio.
La nube de electrones es la región ocupada por estas ondas, visualizada como una densidad de carga negativa alrededor del núcleo.
Cada orbital corresponde a un posible valor de energía para los electrones. Sin embargo, un electrón puede saltar a un nivel superior o a un nivel inferior captando o emitiendo energía.
El concepto de orbital atómico se introdujo por primera vez en el modelo atómico de Schrödinger.
¿Qué importancia tiene la composición de un átomo con la energía nuclear?
La base de todo lo relacionado con la energía nuclear radica en el núcleo del átomo, puesto que la tecnología nuclear se basa en el aprovechamiento de la energía interna contenida en los átomos.
La energía nuclear se obtiene a partir de la división del núcleo de un átomo (fisión nuclear) o de la fusión de dos núcleos atómicos (fusión nuclear).
Cuando esto sucede y la estructura del átomo varía se libera una gran cantidad de energía térmica.
Reacciones nucleares: fisión y fusión de átomos
El núcleo atómico puede verse alterado por procesos muy energéticos que pueden provocar un cambio en la estructura del átomo. Los núcleos inestables de uranio y plutonio pueden sufrir desintegraciones que pueden cambiar el número de protones y neutrones emitiendo radiación.
Un núcleo pesado puede fisionarse en otros más ligeros en una reacción nuclear o espontáneamente. Mediante una cantidad suficiente de energía, dos o más núcleos pueden fusionarse en otro más pesado, en este caso, se trataría de una reacción de fusión nuclear.
Los elementos químicos que tienen un número atómico bajo, los núcleos con diferente número de protones y neutrones tienden a desintegrarse en núcleos con proporciones más parecidas. Sin embargo, los elementos más pesados necesitan una proporción de neutrones mayor para estabilizar el núcleo.
