En 1904, Joseph John Thomson propuso una evolución del modelo atómico de Dalton, dando lugar al famoso modelo de Thomson, una teoría revolucionaria que intentó explicar dos propiedades fundamentales de los átomos en ese momento.
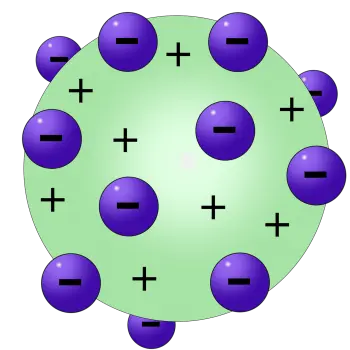
En este modelo, Thomson postuló que los electrones, partículas con carga negativa, estaban dispersos en un fondo de carga positiva, creando una estructura que se asemejaba a un postre británico conocido como el "pudín de pasas". Este curioso apodo proviene de la analogía visual de los electrones (las "pasas") dispersos en un fondo positivo (el "pudín").
Esta nueva teoría atómica de Thomson intentó explicar dos propiedades entonces conocidas de los átomos:
- Los electrones son partículas cargadas negativamente.
- Los átomos no tienen carga eléctrica neutra.
Postulados de Thomson
El modelo atómico de J.J. Thomson, introdujo varios postulados clave que buscaban explicar las propiedades observadas de los átomos en ese momento. Aquí están los postulados fundamentales y sus características:
- Electrones como partículas subatómicas: Thomson postuló la existencia de partículas subatómicas con carga negativa, que más tarde se identificaron como electrones. Este fue un avance importante, ya que hasta ese momento, los átomos se consideraban indivisibles según el modelo atómico de Dalton.
- Estructura esférica del átomo: Thomson imaginó el átomo como una esfera uniforme de carga positiva, donde los electrones, de carga negativa, estaban incrustados como pasas en un pudín. Este concepto de estructura esférica contrastaba con la idea anterior de átomos indivisibles de Dalton.
- Distribución uniforme de electrones: Según el modelo de Thomson, los electrones estaban distribuidos de manera uniforme en toda la esfera cargada positivamente. Esta disposición buscaba explicar la neutralidad eléctrica del átomo en su conjunto.
- Movimiento libre de electrones: Segú este postulado, los electrones se consideraban capaces de moverse libremente dentro de la esfera cargada positivamente, lo que explicaba la estabilidad del átomo. Thomson sugirió que las fuerzas de atracción entre los electrones y la carga positiva circundante eran responsables de mantener a los electrones en sus órbitas.
- Explicación de los espectros de línea: Thomson propuso que los electrones giraban libremente en órbitas anulares dentro del átomo. Las diferencias en las energías de estos niveles orbitales explicarían los espectros de línea observados en la emisión de luz cuando los electrones saltaban entre estas órbitas.
¿Por qué se conoce como el modelo del pudín de pasas?
 El modelo de Thomson ha sido comúnmente comparado con el postre británico conocido como pudín de pasas, lo que le valió su nombre característico. Aunque Thomson no lo describió de esta manera, la analogía fue adoptada por otros para ilustrar mejor su idea.
El modelo de Thomson ha sido comúnmente comparado con el postre británico conocido como pudín de pasas, lo que le valió su nombre característico. Aunque Thomson no lo describió de esta manera, la analogía fue adoptada por otros para ilustrar mejor su idea.
En este modelo, los electrones —cargados negativamente— están distribuidos como si fueran "pasas" incrustadas dentro de una masa de carga positiva, que representa el "pudín". De esta forma, la carga positiva equilibra la carga negativa de los electrones, manteniendo al átomo en su conjunto eléctricamente neutro. Esta representación sencilla, aunque hoy obsoleta, ayudó a visualizar cómo podrían coexistir las partículas subatómicas en un espacio relativamente pequeño, antes de que se conocieran detalles más precisos sobre la estructura del átomo.
Características del modelo atómico de Thomson
Según el modelo atómico de Thomson, el átomo consiste en electrones colocados en una "sopa" cargada positivamente, que compensa las cargas eléctricamente negativas de los electrones.
Según este modelo, los electrones podrían girar libremente en una gota o nube de una sustancia tan cargada positivamente. Sus órbitas se estabilizaron dentro del átomo por el hecho de que cuando un electrón se aleja del centro de una nube cargada positivamente, experimenta un aumento en la fuerza de atracción hacia el centro de la nube.
Esta fuerza de atracción lo devuelve de nuevo al centro. La fuerza de atracción al centro de una nube esférica cargada uniformemente es directamente proporcional a la distancia a su centro.
En el modelo de Thomson, los electrones pueden rotar libremente en órbitas de anillos, que se estabilizan mediante interacciones entre electrones. Los espectros de línea se explicaban por la diferencia de energías cuando se movían a lo largo de diferentes órbitas de anillos.
El modelo de Thomson se convirtió en un precursor del posterior modelo atómico de Bohr, que representa el átomo como una semejanza del sistema solar.
Limitaciones del modelo
El modelo del átomo de Thomson fue refutado en un experimento sobre la dispersión de partículas alfa en una lámina de oro en 1909, que fue analizado por Ernest Rutherford en 1911. El experimento de Rutherford sugería que el átomo tenía un núcleo muy pequeño que contiene una gran carga positiva.
En 1913, Henry Moseley demostró experimentalmente que la carga nuclear en cargas elementales está muy cerca del número atómico.
Este trabajo finalmente condujo a la creación en el mismo año del modelo de Bohr, similar al sistema solar. Según este modelo, el núcleo tiene una carga positiva igual al número atómico y está rodeado por un número igual de electrones en capas orbitales.
El problema de Thomson
Al considerar el modelo de Thomson, se formuló un problema de física matemática aún sin resolver - encontrar la configuración de muchas cargas con la energía potencial más baja en una esfera - el problema de Thomson.
Legado de Thomson
El legado de J.J. Thomson en la física y la química es innegable, no solo por el descubrimiento del electrón, sino también por haber revolucionado la forma en que concebimos los átomos. Aunque el modelo del "pudín de pasas" fue eventualmente reemplazado, representó un paso crucial hacia la comprensión moderna de la materia.
Thomson desafió la noción de que los átomos eran indivisibles con sus postulados y abrió las puertas a una era de investigación subatómica.
En mi opinión, lo más admirable del trabajo de Thomson es su capacidad para ver más allá de las ideas aceptadas y proponer algo completamente nuevo, lo que requiere una notable valentía intelectual.
El modelo que se deriva de sus postulados, aunque sencillo comparado con los avances posteriores, fue clave en el desarrollo de la física moderna. Es un recordatorio de que cada teoría, incluso si se perfecciona o se descarta con el tiempo, puede ser la chispa que impulse el siguiente gran avance científico.
En este sentido, el legado de Thomson no radica solo en su modelo atómico, sino en su capacidad para cuestionar lo establecido y promover una nueva forma de pensar sobre la naturaleza de la materia. Sin su trabajo, la comprensión actual del átomo no habría sido posible.
