La masa molar es una propiedad física que se utiliza para describir la masa promedio de un átomo o molécula de una sustancia en unidades de gramos por mol (g/mol) y se representa con la letra "M".
En otras palabras, la masa molar indica cuántos gramos de una sustancia hay en un mol de esa sustancia. El mol es una unidad de cantidad de sustancia en el Sistema Internacional de Unidades (SI).
Unidades de medida
En el Sistema Internacional de Unidades (SI), la unidad para medir la masa molar es kilogramo por mol (kg/mol). Sin embargo, cuando la masa molar se expresa en g/mol, su valor numérico es el mismo con el peso molecular relativo. Por esta razón, históricamente el peso molar se expresa generalmente en gramos por mol (g/mol).
La masa molar en las fórmulas generalmente se indica con una letra mayúscula M.
Las comparaciones directas y las mediciones de las masas de átomos y moléculas se realizan utilizando métodos de espectrometría de masas.
Cálculo de la masa molar
El cálculo de la masa molar de un compuesto se realiza sumando las masas de todos los átomos en una molécula utilizando las masas atómicas relativas.
Las masas atómicas relativas son números que representan la masa de un átomo en relación con la masa del átomo de carbono-12, que se define como 12 unidades de masa atómica (uma).
Por ejemplo, la masa atómica relativa del hidrógeno es aproximadamente 1 uma, mientras que la masa atómica relativa del oxígeno es aproximadamente 16 uma.
Moléculas complejas
 Para calcular el número de las masas molares de moléculas complejas se puede determinar sumando las masas molares de sus elementos constituyentes. Por ejemplo, la masa molar de agua H2O hay
Para calcular el número de las masas molares de moléculas complejas se puede determinar sumando las masas molares de sus elementos constituyentes. Por ejemplo, la masa molar de agua H2O hay
M (H2O) = 2 M (H) + M (O) = 2.1 g / mol + 16 g / mol = 18.1 g / mol
Calcular la masa molar paso a paso
El cálculo de la masa molar de una sustancia química se puede realizar siguiendo estos pasos:
-
Identificar la fórmula química del compuesto químico.
-
Determinar cuántos átomos de cada elemento hay en la fórmula química.
-
Multiplicar el número de átomos de cada elemento por su masa atómica relativa.
-
Sumar las masas de todos los átomos en la fórmula para obtener la masa molar.
Ejemplo práctico
Veamos un ejemplo concreto para calcular la masa molar del agua (H₂O):
-
La fórmula química del agua es H₂O, lo que significa que contiene dos átomos de hidrógeno (H) y un átomo de oxígeno (O).
-
La masa atómica relativa del hidrógeno es aproximadamente 1 uma y la del oxígeno es aproximadamente 16 uma.
-
Para calcular la masa molar del agua, sumamos las masas de los átomos: (2 * 1 uma) + (1 * 16 uma) = 2 uma + 16 uma = 18 uma.
Por lo tanto, la masa molar del agua es de 18 g/mol.
Ejemplos de masa molar
A continuación, se presenta una tabla con ejemplos de algunas masas molares de diferentes sustancias:
|
sustancia |
Fórmula química |
Masa molar (g/mol) |
Descripción |
|
Hidrógeno |
H₂ |
2 |
El hidrógeno es el elemento más ligero, con una masa molar de 2 g/mol. |
|
Oxígeno |
O₂ |
32 |
El oxígeno es esencial para la respiración y tiene una masa molar de 32 g/mol. |
|
Dióxido de Carbono |
CO₂ |
44 |
El CO₂ es un gas de efecto invernadero con una masa molar de 44 g/mol. |
|
Amoníaco |
NH₃ |
17 |
El amoníaco se utiliza en la industria química y tiene una masa molar de 17 g/mol. |
|
Metano |
CH₄ |
16 |
El metano es el componente principal del gas natural y tiene una masa molar de 16 g/mol. |
|
Ácido Sulfúrico |
H₂SO₄ |
98 |
El ácido sulfúrico es un ácido fuerte ampliamente utilizado con una masa molar de 98 g/mol. |
|
Glucosa |
C₆H₁₂O₆ |
180 |
La glucosa es un azúcar que se encuentra en alimentos y tiene una masa molar de 180 g/mol. |
|
Cloruro de Sodio (sal de mesa) |
NaCl |
58.5 |
El cloruro de sodio es la sal de mesa común y tiene una masa molar de 58.5 g/mol. |
|
Uranio |
U |
238.03 |
El uranio es un elemento utilizado como combustible en reactores nucleares. |
|
Plutonio |
Pu |
244 |
El plutonio es un elemento utilizado en armas nucleares y reactores nucleares. |
|
Agua Pesada |
D₂O |
20.03 |
El agua pesada contiene deuterio en lugar de hidrógeno y se usa en reactores nucleares. |
|
Uranio Enriquecido |
U-235 |
Varía |
El uranio enriquecido contiene una mayor proporción de U-235 y es esencial para la fisión nuclear. |
Uso y aplicaciones de la masa molar
La masa molar es una propiedad fundamental que tiene varias implicaciones y aplicaciones en la química y otras disciplinas científicas.
Algunas de sus aplicaciones más destacadas incluyen:
-
Conversión entre moles y gramos: se utiliza para convertir entre la cantidad de sustancia en moles y la masa en gramos de una sustancia.
-
Determinación de la composición de las sustancias.
-
Cálculo de reacciones químicas: es esencial para calcular las cantidades de reactantes y productos en una reacción química, lo que permite la estequiometría y la planificación de experimentos.
-
Identificación de sustancias desconocidas: se utiliza en técnicas analíticas, como la espectroscopia de masas, para identificar sustancias desconocidas a través de la comparación de sus masas molares experimentales con las masas molares calculadas.
-
Aplicaciones en termodinámica: en la termodinámica química se utiliza para calcular propiedades como la entalpía y la entropía de reacciones químicas.
Importancia de la vida cotidiana
La masa molar no solo es importante en el laboratorio, sino que también tiene aplicaciones en la vida cotidiana. Algunos ejemplos incluyen:
-
Nutrición: en la industria alimentaria, se utiliza para calcular la cantidad de nutrientes en los alimentos y para establecer las recomendaciones de consumo diario de nutrientes esenciales como proteínas, carbohidratos y grasas.
-
Farmacología: en la formulación de medicamentos, es crucial conocer la masa molar de los componentes activos y los excipientes para garantizar la dosificación adecuada y la eficacia del medicamento.
-
Energía: en la industria energética, la masa molar se utiliza en la producción y el uso de combustibles y energía renovable, como el cálculo de la densidad de los combustibles y la eficiencia de las celdas de combustible.
Relación con la tabla periódica
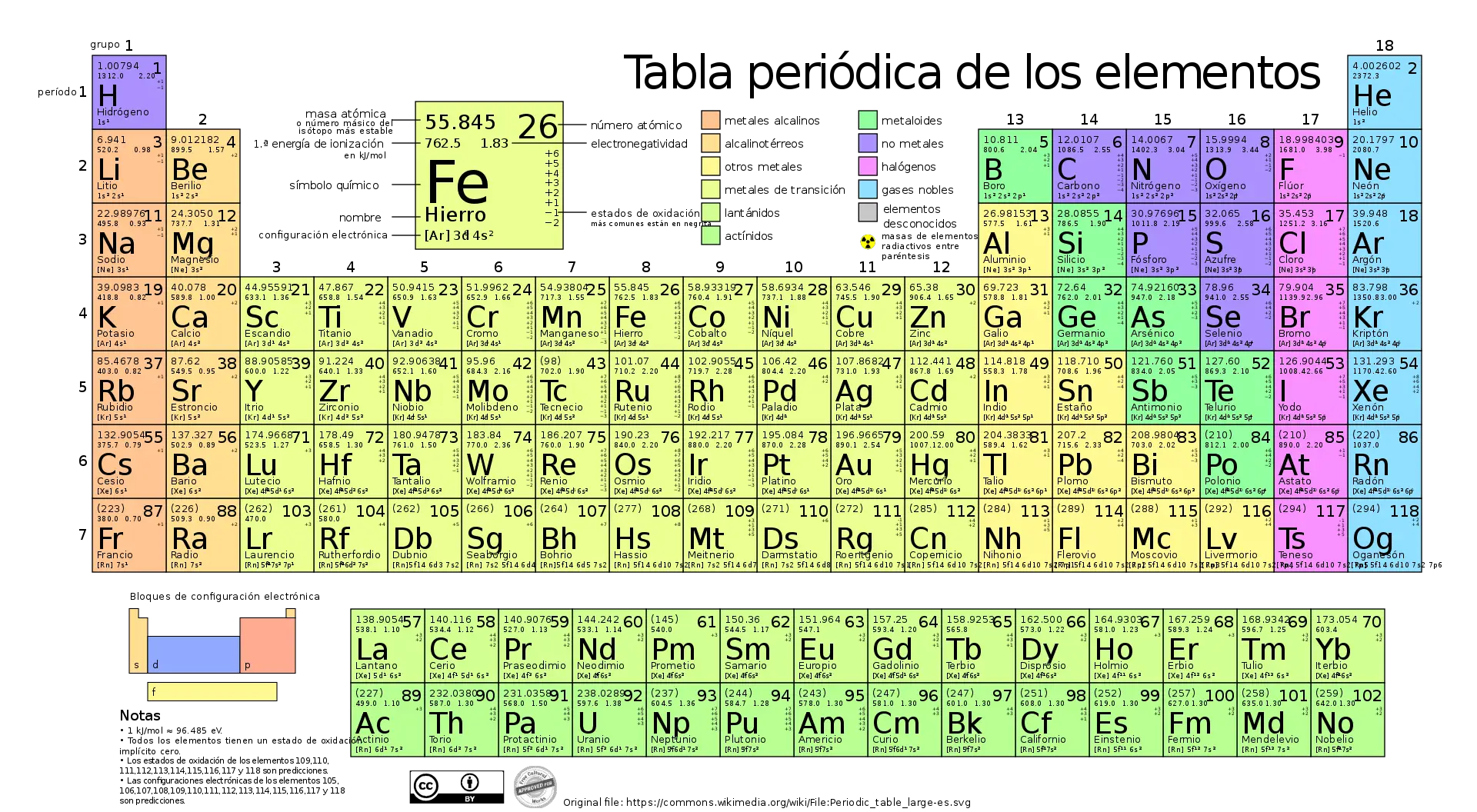 La tabla periódica de los elementos químicos es una herramienta invaluable para determinar las masas molares de elementos y compuestos. Cada elemento en la tabla periódica tiene una masa atómica relativa que se redondea a números enteros o fracciones simples en el caso de isótopos.
La tabla periódica de los elementos químicos es una herramienta invaluable para determinar las masas molares de elementos y compuestos. Cada elemento en la tabla periódica tiene una masa atómica relativa que se redondea a números enteros o fracciones simples en el caso de isótopos.
Para calcular la masa molar de un compuesto, simplemente se suman las masas atómicas relativas de los elementos presentes, multiplicadas por el número de átomos de cada elemento en la fórmula.
Ejemplo del cloruro de sodio
Un ejemplo interesante es calcular la masa molar del cloruro de sodio (NaCl).
El sodio (Na) tiene una masa atómica relativa de aproximadamente 23 uma, y el cloro (Cl) tiene una masa atómica relativa de aproximadamente 35.5 uma.
Por lo tanto, la masa molar del NaCl es la suma de estas masas atómicas: 23 uma + 35.5 uma = 58.5 uma, que es equivalente a 58.5 g/mol.
No confundir con...
La masa molar suele confundirse con otros conceptos en química y física debido a que todos están relacionados con el peso o la cantidad de sustancia. Aquí hay algunos conceptos con los que comúnmente se confunde:
- Masa molecular: La masa molecular es la suma de las masas atómicas de los átomos en una molécula, igual que la masa molar, pero expresada en unidades de masa atómica (uma o u), no en g/mol. La masa molar y la masa molecular tienen el mismo valor numérico, pero se diferencian en sus unidades y en el contexto en el que se usan.
- Masa atómica: Este es el promedio de la masa de los átomos de un elemento, teniendo en cuenta la abundancia de sus isótopos, y se mide en unidades de masa atómica (u). La masa atómica se usa para calcular la masa molar de un elemento en el contexto de una sustancia.
- Peso molecular: Este término antiguamente se usaba como sinónimo de masa molecular, pero no es correcto. El peso es una fuerza (resultado de la gravedad actuando sobre una masa) y se mide en newtons (N), mientras que la masa molecular es una medida de la cantidad de materia en unidades de masa atómica. Es más correcto hablar de masa molecular que de peso molecular.
- Cantidad de sustancia (mol): A veces se confunde con la masa molar porque ambos conceptos involucran el mol. Sin embargo, la cantidad de sustancia (mol) es una medida de la cantidad de partículas (átomos, moléculas, iones) en una muestra y no de su masa. La masa molar, en cambio, representa la masa de un mol de esas partículas.
- Volumen molar: Este concepto se refiere al volumen que ocupa un mol de una sustancia, especialmente en el contexto de gases, y suele expresarse en L/mol. Es diferente de la masa molar, que mide la cantidad de masa en gramos por cada mol de sustancia.
