La tabla periódica de elementos es una tabla que contiene representados todos los elementos químicos conocidos.
Durante el siglo XIX, los químicos comenzaron a clasificar los elementos químicos que se conocían según sus propiedades físicas y químicas. En 1860 se organizó el primer Congreso Internacional de Químicos en la ciudad alemana de Karlsruhe con el objetivo de unificar el criterio para la clasificación de los elementos. Esta reunión fue crucial en la historia de la ciencia y el origen de la creación de la tabla que hoy en día aparece en los libros de texto.
De acuerdo con la Unión Internacional de Química Pura y Aplicada (IUPAC) la tabla periódica de los elementos químicos nació el 1 de marzo de 1869.
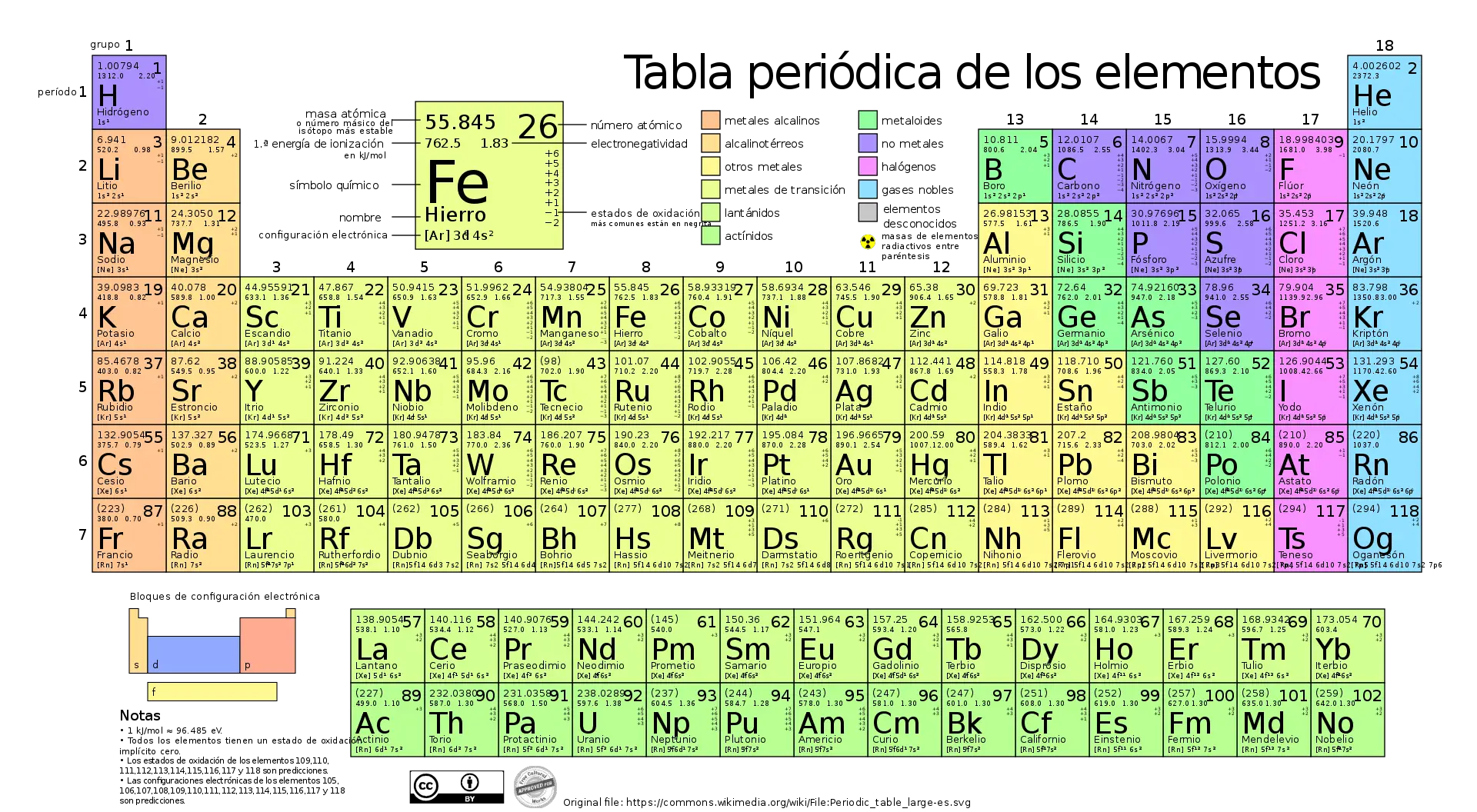
Actualmente la tabla periódica contiene 118 elementos químicos.
Los últimos elementos que se introdujeron en la tabla periódica son los elementos 113, 115, 117 y 118. Los nombres de estos nuevos elementos son Nihonio, Moscovio, Téneso y Oganesón, respectivamente. Esta incorporación se realizó el 1 de diciembre del 2016.
Ordenación de los elementos químicos
Dentro de la tabla periódica los elementos químicos están ordenados según sus números atómicos, es decir, el número de protones en el núcleo del átomo.
La tabla periódica está organizada en filas y columnas. Las columnas se denominan grupos, mientras que las filas se conocen como períodos.
Los elementos se colocan de forma que los elementos con configuraciones electrónicas similares están una encima de la otra. También está ordenado para que los elementos con comportamientos similares estén en la misma columna.
Usos y aplicaciones de la tabla periódica
 La tabla periódica tiene múltiples utilidades en química y en otras ciencias. Las más importantes son:
La tabla periódica tiene múltiples utilidades en química y en otras ciencias. Las más importantes son:
-
Mostrar las relaciones entre los diferentes elementos químicos.
-
Predecir las propiedades de elementos recién descubiertos o que todavía no se han sintetizado.
-
Proporciona una imagen útil al analizar los comportamientos químicos de las sustancias químicas.
Periodos: las filas de la tabla
Un período en la tabla periódica corresponde a una fila horizontal. Normalmente las tendencias periódicas más claras se aprecian en los grupos, sin embargo, existen ciertas regiones de la tabla en que las tendencias en el sentido horizontal son más destacadas.
Los elementos del mismo período de la tabla muestran tendencias en el potencial de ionización, el radio atómico y la afinidad electrónica y electronegatividad.
De izquierda a derecha en un período, el radio atómico generalmente disminuye. Esto se debe a que en esta dirección cada elemento de la tabla tiene un electrón y un protón extra, y los electrones se aproximan al núcleo. Esta disminución del radio atómico asegura que en un período el potencial de ionización también aumentará de izquierda a derecha.
La electronegatividad crece al igual que lo hace el potencial de ionización. Este aumento se debe a que el núcleo atrae a los electrones.
Grupos o familias: las columnas de la tabla
Un grupo o familia es una columna de la tabla periódica de los elementos químicos. Habitualmente, los grupos tienen tendencias periódicas más destacadas que los bloques y períodos.
Los elementos químicos que pertenecen al mismo grupo presentan propiedades químicas similares. Además hay una clara tendencia a aumentar de los números atómicos. Pero en algunas partes de la tabla las similitudes horizontales y verticales pueden ser igual de importantes.
Propiedades de los elementos dentro del grupo
Los elementos del mismo grupo tienden a exhibir patrones de radio atómico, potencial de ionización y electronegatividad. De arriba a abajo, el radio atómico de los elementos aumentará por grupo, ya que hay más electrones y los electrones de valencia estarán más alejados del núcleo del átomo.
Desde la parte de arriba, cada elemento químico tiene un potencial de ionización más débil. Esto se debe a que resulta más sencillo eliminar un electrón ya que la fuerza con la que están unidos los átomos es más débil.
La electronegatividad de las familias en general se reduce al bajar en la tabla. Esta bajada se debe al aumento de la distancia entre el núcleo y los electrones de valencia.
Bloques de la tabla periódica
Los bloques son las regiones específicas de la tabla periódica de los elementos. El nombre de bloque corresponde al de la capa que contiene el último electrón.
En la tabla periódica existen los siguientes bloques:
-
El bloque “s”: engloba el primer y el segundo grupo que corresponde al hidrógeno, el helio, los metales alcalinos y metales alcalinotérreos.
-
El bloque “p” incluye los últimos seis grupos. Entre otros elementos, incluye los gases nobles y los metaloides.
-
El bloque “d” incluye los grupos comprendidos entre el 3 y el 12. Este bloque contiene todos los metales de transición.
-
El bloque “f” no tiene números de grupo. Frecuentemente se representa debajo del resto de la tabla. El bloque “f” los actínidos y los lantánidos.
¿A quién se le atribuye la tabla periódica?
La primera tabla periódica reconocible fue publicada por el químico ruso Dmitri Mendeléyev en 1869 en una obra llamada “Principios de química”. La forma en la que hoy organizamos los elementos químicos sigue todavía la propuesta de Mendeléyev.
 Al mismo momento, el químico alemán Julius Lothar Meyer, contemporáneo competidor de Mendeléyev, también trabajó con la idea de crear la primera tabla periódica. Meyer ordenó los elementos a partir de las propiedades físicas de los átomos pero su propuesta no tuvo tanta aceptación.
Al mismo momento, el químico alemán Julius Lothar Meyer, contemporáneo competidor de Mendeléyev, también trabajó con la idea de crear la primera tabla periódica. Meyer ordenó los elementos a partir de las propiedades físicas de los átomos pero su propuesta no tuvo tanta aceptación.
Desde su creación, la tabla periódica de los elementos de Mendeleev se ha completado y ampliado a medida que se han descubierto o sintetizado otros elementos.
Sin embargo, algunos científicos opinan que la versión definitiva de la tabla se consiguió gracias a la ley periódica presentada a comienzos del siglo XX por Henry Moseley.
A pesar de la importancia histórica, la propuesta de la tabla de Mendeléyev fue un momento más en la línea del tiempo de la tabla periódica.
Las predicciones de Dmitri Mendeléyev
Mendeléyev desarrolló su tabla para mostrar tendencias periódicas en los 63 elementos químicos que se conocían en aquél momento. También predijo algunas propiedades de sustancias químicas que en aquél momento se desconocían pero que esperaba llenarían los vacíos en la tabla.
Cuando se descubrieron esos nuevos elementos, sus predicciones resultaron ser en gran parte correctas.
